| zurück
Home |
Cs, Caesium |
| allgemeines |
extrem reaktives, sehr weiches, goldfarbenes, in hochreinem Zustand silbrig glänzendes Alkalimetall |
2 blaue Spektrallinien: 455 und 459 nm |
Die Erdhülle enthält 6,5 ppm Caesium. Meerwasser 0,3 bis 4 µg Caesium |
| atomare Eigenschaften |
| Ordnungszahl |
55 |
| Atommasse | 132,90545196 |
| Atomradius | 265 pm | berechnet | 298 pm |
| Kovalent | 244 pm |
| Van-der-Waals | 343 pm |
| Austrittsarbeit | 2,14 eV |
| Ionisierungsenergie | 1. | 375,7 kJ/mol |
| 2. | ? kJ/mol |
| 3. | ?/mol |
| 4. | ? kJ/mol |
|
physikalische Eigenschaften |
| Dichte | 1,9 g/cm3 |
| Mohshärte | 0,2 |
| Kristallstruktur | kubisch-raumzentriert |
| paramagnetisch | Χm = 5,2 · 10-6 |
| Schmelzpunkt | 28,44 °C |
| Siedepunkt | 690 °C |
| Molares Volumen | 70,94 · cm3 / mol (fest) |
| Verdampfungswärme | 66,1 kJ/mol |
| Schmelzwärme | 2,09 kJ/mol |
| Elektrische Leitfähigkeit | 4,76 * 106 A/(V · m) |
| Wärmeleitfähigkeit | 36 W/(m · K) |
| Spezifische Wärmekapazität | ? J/(kg · K) |
| Schallgeschwindigkeit | ? m/s |
|
| chemische Eigenschaften |
| Oxidationszahlen | +1 |
| Normalpotential | -2,923 V |
Cs+ + e- → Cs |
| Elektronegativität | 0,79 |
| Elektronenkonfiguration | [Xe] 6s1 |
| Periodensystem | Gruppe 1, Periode 6, Block ? |
|
| Isotope |
| Isotop | Anteil | Halbwertszeit |
Zerfallsart | Energie | Zerfallsprodukt |
| 131Cs | - | 9,689 d |
Elektroneneinfang | 0,352 MeV | 131Xe |
| 132Cs | - | 6,479 d |
Elektroneneinfang | 2,12 MeV | 132Xe |
| β− | 1,280 MeV | 132Ba |
| 133Cs | 100% | - |
- | - | - |
| 134Cs | - | 2,0648 a |
β− | 2,059 MeV | 134Ba |
| 135Cs | - | 2,3 · 106 a |
β− | 0,2 MeV | 135Ba |
| 136Cs | - | 13,16 d |
β− | 2,548 MeV | 136Ba |
| 137Cs | - | 30,17 a |
β− | 0,512 MeV | 137mBa |
| β− | 1,176 MeV | 137Ba | In der Strahlentherapie: Afterloading,
in Prüfstrahlern. Abfallprodukt der Kernspaltung (Tschernobyl)
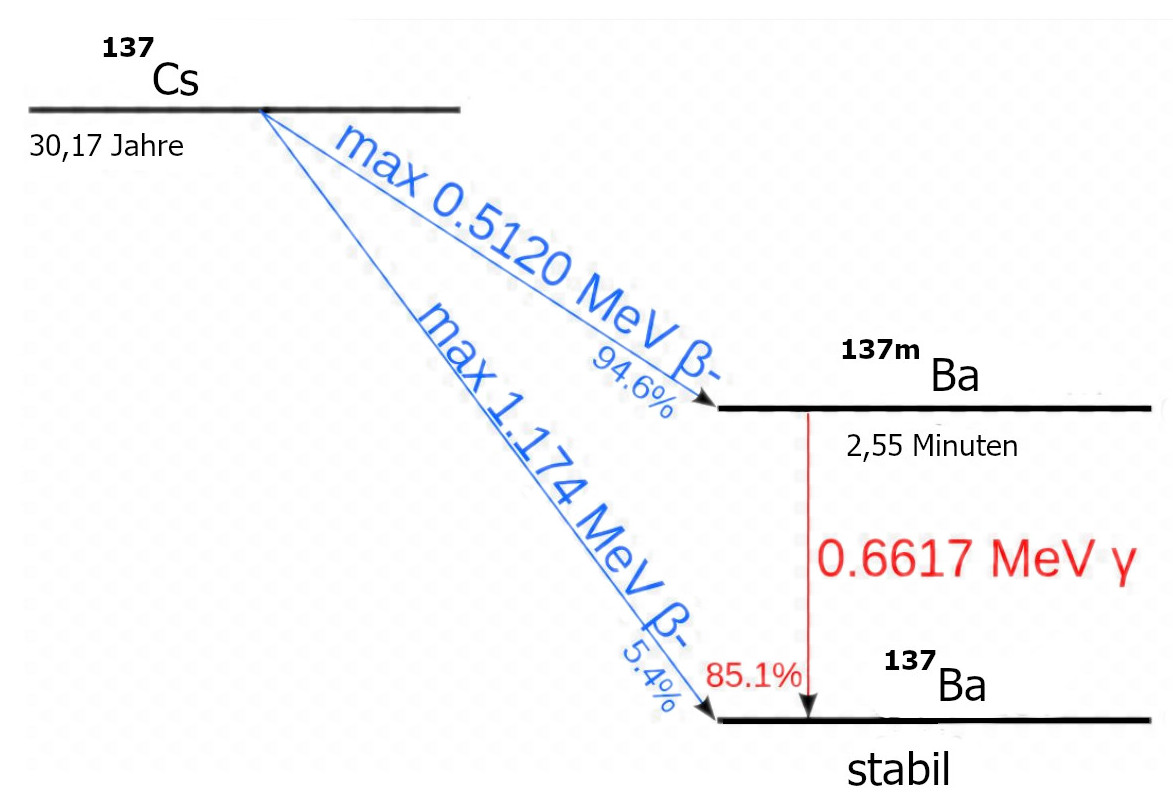
Modifiziert nach Tubas-en - http://www.springerlink.com/content/rm0v8727k2j02x85/, p. 492, doi:10.1007/978-3-642-00875-7, Gemeinfrei, Link |
|
| Mineralien |
| (Cs,Na)2 Al2 Si4 O12 · H2O |
Pollucit |
|
|
|
|
| (Cs,Na) Sb Ta4 O12 |
Cesstibtantit |
|
|
| Cs Fe2 S3 |
Pautovit |
|
|
|
|
|
| |
|
|
|
|
| Verbindungen |
| Cs O2 |
|
|
|
| Cs OH |
|
|
|
|
|
|
| Cs Cl O4 |
Caesium-Perchlorat |
|
|
| Cs2 [Pt Cl6] |
Caesium-Hexachloridoplatinat |
|
|
|
| Verwendung |
Als Glühkathode etwa zur Gewinnung freier Elektronen |
Als Getter in Vakuumröhren. |
| Biologie |
Der Maronen-Röhrling (Boletus badius) und der Flockenstielige Hexen-Röhrling (Boletus erythropus) reichern Caesium an. |
Die Hutfarbstoffe Badion A und Norbadion A bilden Komplexe mit Caesium |
Maximal 600 Bq Cs-137/kg Pilze pro Kilogramm erlaubt. |
Teil von |
Periodensystem |
Anorganische Chemie |
Chemie |
