BOLERO - 2
Allgemeines
Breast Cancer Trials of Oral Everolimus-2
Fragestellung
Verbessern Everolismus und Exemestan das Therapieergebnis einer progredienten Metastasierung nach Aromatasehemmerbehandlung gegenüber einer alleinigen Exemestan-Behandlung eines rezeptorpositiven, postmenopausalen Mammakarzinoms?
Ergebnis
Everolismus und Exemestan verlängern signifikant das progressionsfreie Überleben einer progredienten Metastasierung gegenüber einer alleinigen Exemestan-Behandlung.
Patientinnen
- 724 postmenopausale Frauen
- ER+
- Her2-
- metastasiertes oder fortgeschrittenes Mammakarzinom
- Progredienz unter Letrezol oder Anastrozol
Arm A
Arm B
Nur Exemestan (25 mg/Tag) (n = 239)
Metastasen
Ergebnis
| Arm | nur Exemesan | Everolismus und Exemesan | Statistik |
| PFS | 4,1 M | 11 M | HR 0,38; p < 0,0001 |
| Stomatitis | 1% | 8% | |
| Anemie | 1% | 6% | |
| Dyspnoe | 1% | 4% | |
| Hyperglykemie | <1% | 4% | |
| Pneumonitis | 0% | 3% |
PFS
Progressionsfreies Überleben mit Everolimus deutlich besser.
 modifiziert nach (3).
modifiziert nach (3).
PFS
Progressionsfreies Überleben: Auswahl der Frauen mit first-line-Therapie.
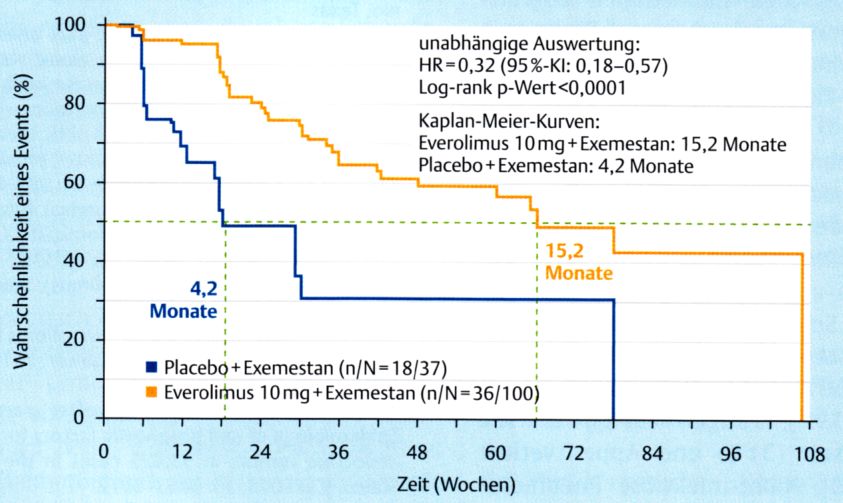 modifiziert nach (3).
modifiziert nach (3).
Studie
Randomisiert, Phase III
Quellen
1.) Baselga J, Campone M, Piccart M, et al.:
Everolimus in Postmenopausal Hormone-Receptor–Positive Advanced Breast Cancer.
N Engl J Med 366(2012):520-9.
2.) Beck JT, Hortobagyi GN, Campone M, et al.:
Everolimus plus exemestane as first-line therapy in HR⁺, HER2⁻ advanced breast cancer in BOLERO-2.
Breast Cancer Res Treat 143(2014): 459–467
3.) Yardley DA et al.:
Everolismus plus exemestan in postmenopausal patients with HR+ breast cancer: BOLERO-2 final progression-free survival analysis.
Adv Ther 30(2013):870-884
4.) Hortobagyi GN, et al.:
Correlative Analysis of Genetic Alterations and Everolimus Benefit in Hormone Receptor – Positive, Human Epidermal Growth Factor Receptor 2 – Negative Advanced Breast Cancer: Results From BOLERO-2.
J Clin Oncol 2016;34:419-426
