| zurück
Home |
O, Sauerstoff |
| allgemeines |
Ionisierter Sauerstoff leuchtet grün:  |
Masseanteil der Erdhülle 49% |
| Verbindungen |
H2O,
H2O2, CO2, CO,
O3 |
organische Sauerstoffverbindungen |
Alkohole,
Äther, Aldehyde, Carbonsäuren |
Al(OH)3 |
| atomare Eigenschaften |
| Ordnungazahl |
8 |
| Atommasse |
15,999 |
| Atomradius |
berechnet |
60 |
| Kovalent |
66 pm |
| Van-der-Waals |
152 pm |
| Austrittsarbeit |
4,26 eV |
| Ionisierungsenergie |
1. |
1313,9 kJ/mol |
| 2. |
3388,3 kJ/mol |
| 3. |
5300,5 kJ/mol |
| 4. |
7469,2 kJ/mol |
Emission: einfach ionisierter Sauerstoff: Ultraviolet 372,7 nm, doppelt ionisiert: blau-grün 500,7 nm |
physikalische Eigenschaften
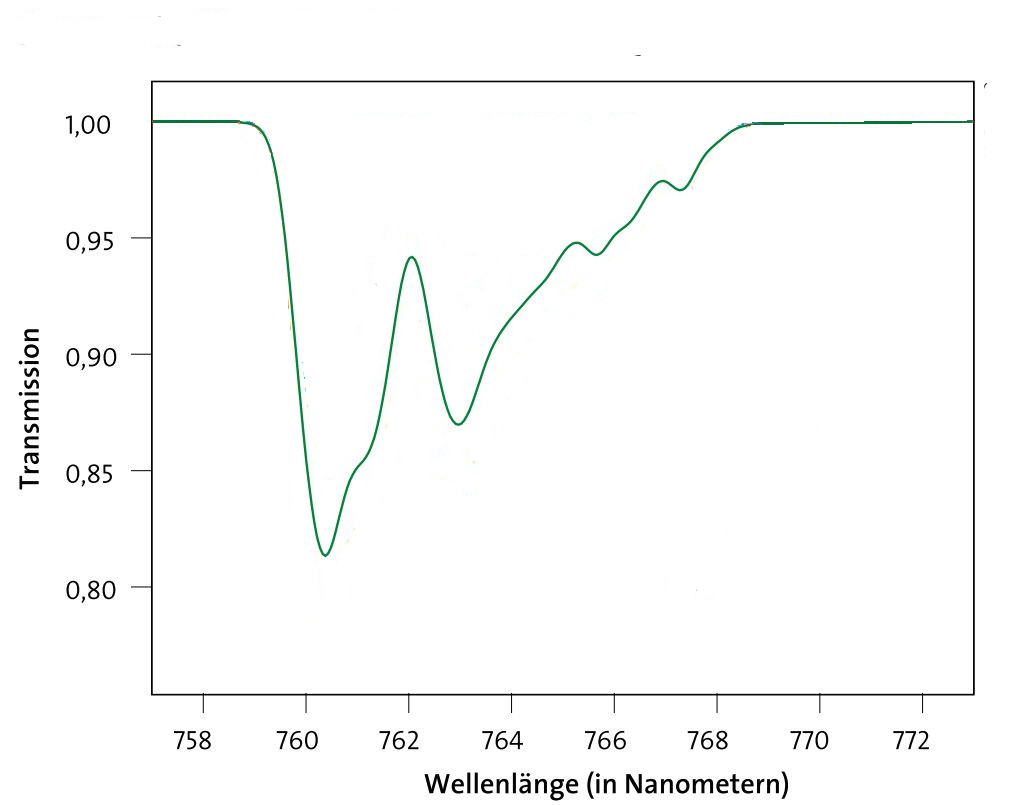
Absorption von gasförmigem Sauerstoff. |
| Dichte |
1,429 kg /m3 |
| Mohshärte |
|
| Kristallstruktur |
kubisch |
| paramagnetisch |
Χm= 1,9 · 10-5 |
| Schmelzpunkt |
−218,3°C |
| Siedepunkt |
−182,9°C |
| Molares Volumen |
10,27 · cm3 / mol |
| Verdampfungswärme |
6,82 kJ/mol |
| Schmelzwärme |
0,222 kJ/mol |
| Elektrische Leitfähigkeit |
* 106 A/(V · m) |
| Wärmeleitfähigkeit |
0,02658 W/(m · K) |
| Schallgeschwindigkeit |
317,5 m/s |
| Spezifische Wärmekapazität |
920 J/(kg · K) |
|
| chemische Eigenschaften |
| Oxidationszahlen |
−2, −1, 0, +1, +2 |
| Elektronegativität |
3,44 |
| Normalpotential |
1,23 V |
|
| Elektronenkonfiguration |
[He]2s2 2p4 |
| Periodensystem |
Gruppe 16 , Periode 2, Block p |
|
| Isotope |
| Isotop |
Anteil |
Halbwertszeit |
Zerfallsart |
Energie |
Zerfallsprodukt |
Bemerkungen |
| 14O |
- |
70,606 s |
K/β+ |
5,143 MeV |
14N |
| 15O |
- |
122,24 s |
K/β+ |
2,754 MeV |
15N |
Entsteht bei Therapie-Beschleunigern durch Kollision von Photonen mit Luftsauerstoff. |
| 16O |
99,762 % |
stabil |
|
| 17O |
0,038 % |
stabil |
|
| 18O |
0,200 % |
stabil |
|
|
| 19O |
- |
26,91 s |
β− |
4,821 MeV |
19F |
| 20O |
- |
13,51 s |
β− |
3,814 MeV |
20F |
| 21O |
- |
3,42 s |
β− |
8,109 MeV |
21F |
| 22O |
- |
2,25 s |
β− |
6,49 MeV |
22F |
|
16O / 18O zur Temperaturbestimmung des Meeres in der Vergangenheit.
Das leichtere 16O verdunstet bevorzugt gegenüber 18O.
Das Verhältnis 16O / 18O ändert sich mit der Wassertemperatur. |
| Atmosphaere |
Mit zunehmender Höhe nimmt der Sauerstoffpartialdruck ab.
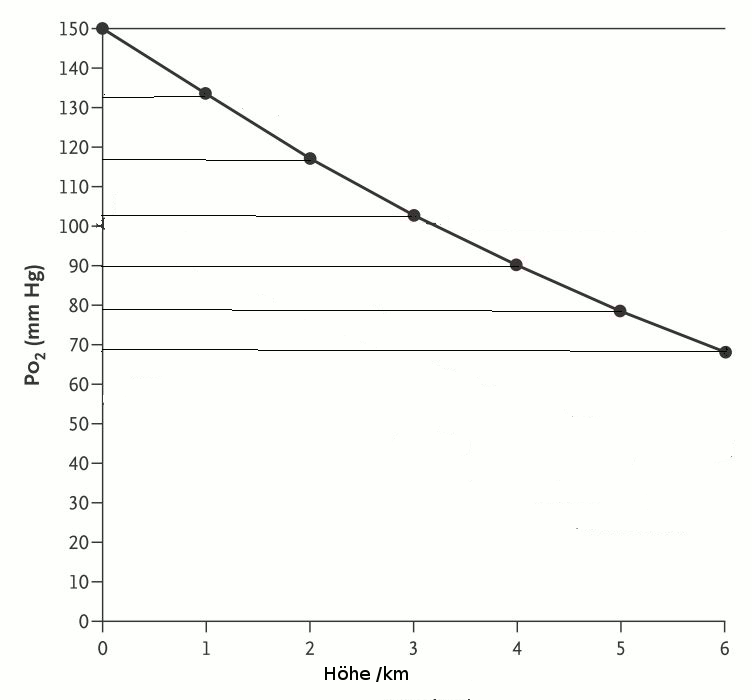 |
| Singulett-Sauerstoff |
| 1O2, angeregte Zustände |
Spins der Elektronen antiparallel |
Entweder befinden sich die beiden Elektronen in einem (1Δg) oder beiden π*-Orbitalen (1Σg) befinden. |
| 1Σg-Zustand |
Beide Elektronen in einem π*-Orbitalen |
energetisch ungünstiger und wandelt sich sehr schnell in den 1Δg-Zustand um. Lebensdauer < 10-9 s |
| 1Δg-Zustand |
Beide Elektronen in beiden π*-Orbitalen |
Lebensdauer 10-4 s |
| 3Σg-Zustand |
Elektronen in beiden π*-Orbitalen parallel |
stabil |
| Energie |
3Σg - 1Δg 95 kJ/mol |
1Σg - 1Δg 63 kJ/mol |
| chemische Eigenschaften |
Starkes und selektives Oxidationsmittel |
|
| Gewinnung |
Destillation von Luft |
Abtrennung aus Luft durch Molekularsiebe |
Elektrolyse von Wasser |
| Wasserlöslichkeit |
| mg/l: |
14,6 |
9,1 |
<4 |
| 0 °C |
20 °C |
Fische: kritisch |
|
Teil von |
Periodensystem |
chemische Elemente |
Quellen |
|
 |


